Ну, а самая эффективная очистка воды в домашних условиях — это «миссия» фильтра обратного осмоса. С его помощью анализ воды можно «пропустить»: Специальная мембрана полностью устраняет жесткость и все вредные примеси.
Основные параметры воды (показатели GH, KH и pH)
Основными параметрами воды в аквариуме являются общая жесткость (GH), карбонатная жесткость или временная жесткость (KH) и водородный показатель (pH). Эти показатели имеют решающее значение для ухода за пресноводными рыбами и креветками, и каждый аквариумист должен их знать.
Прежде всего, вспомните школьный урок химии о растворении веществ. Когда вещество растворяется в воде, оно растворяется, то есть распадается на отрицательные (анионы) и положительные (катионы) ионы. Например, если положить в воду поваренную соль, хлорид натрия (NaCl), то она распадается на катион Na+ и анион Cl-.
Диссоциация хлорида натрия (NaCl)
Поваренная соль распадается на ионы — катион Na+ и анион Cl-.
Растворенные вещества ведут себя аналогично, и от них напрямую зависят GH, KH и, косвенно, значение pH.
Общая жёсткость воды GH
Жесткость воды определяется суммой растворенных в ней ионов щелочноземельных металлов. В основном это ионы кальция (катионы Ca+) и магния (катионы Mg+). Если они присутствуют в большом количестве, вода жесткая, если в малом — мягкая.
Общая жёсткость воды
Исторически сложилось так, что жесткость воды в аквариумистике называется GH (градусы жесткости) и указывается в немецких dGH (или сокращенно dH) или американских ppm (части на миллион). Обе единицы легко конвертируются друг в друга.
В Европе, а также с некоторой опаской и в бывшем Советском Союзе, широко используются немецкие градусы и уровни твердости. Именно так выражается жесткость в тестах на анализ воды наиболее популярных марок (JBL, API, Tetra, ADA, Sera и других).
В целях адаптации к европейским стандартам с 2007 года в Германии действует следующая классификация жесткости воды: от 0 до 8,4 dGH — мягкая, от 8,4 до 14 dGH — средней жесткости, выше 14 dGH — жесткая.
Оптимальный диапазон GH для большинства видов рыб составляет от 4 до 16 dGH.
Стоит отметить, что некоторые производители тестов для аквариумной воды все еще используют старый диапазон жесткости воды (действовавший до 2007 года), который выглядит следующим образом: от 0 до 5 dGH — очень мягкая, от 5 до 10 dGH — мягкая, от 10 до 20 dGH — умеренно жесткая, от 20 до 30 dGH — жесткая, свыше 30 dGH — очень жесткая.
В этом диапазоне оптимальным считается диапазон от 5 до 20 градусов dGH.
Почему важен показатель GH?
В природе параметры воды варьируются от региона к региону. В каждом регионе рыба адаптирована к своей уникальной среде обитания. Виды, обитающие в мягкой воде, подвергаются повышенному осмотическому давлению в среде с высоким GH, что приводит к стрессу и нарушению обмена веществ. С другой стороны, недостаток некоторых щелочноземельных ионов, особенно кальция и магния, приводит к проблемам роста, что особенно критично для декоративных креветок.
Поэтому важно поддерживать значения GH в соответствии с описанием рыб в аквариуме, чтобы обеспечить благоприятные условия содержания.
Карбонатная жёсткость KH
Щелочноземельные металлы встречаются в воде в составе других веществ. Партнерами Ca и Mg обычно являются хлорид (Cl2), сульфат (SO4), карбонат (CO3) и гидрокарбонат (HCO3). Наличие в воде анионов CO3 и HCO3 называется карбонатной жесткостью. Ее также называют временной жесткостью, поскольку карбонаты легко удаляются из воды при кипячении, выпадая в осадок в виде привычной соли.
В отличие от временной жесткости, существует также постоянная жесткость, которая вызывается остаточными анионами Cl2 и SO4 в воде. Термин «постоянная» используется потому, что соли хлоридов и сульфатов не могут быть удалены кипячением.
Временная или карбонатная жёсткость воды
Карбонатная жесткость является частью общей жесткости и также измеряется в немецкой единице dKH и обозначается как KH (зависит от карбонатной жесткости). Классификация аналогична GH, но чаще используется более старая шкала твердости (действовавшая до 2007 года), обычно ограниченная диапазоном от 0 до 20 dKH.
Следует отметить, что карбонаты могут быть связаны не только со щелочноземельными металлами (Ca и Mg); наиболее важным примером является распространенная пищевая сода — бикарбонат натрия (NaHCO3). Когда бикарбонат натрия растворяется в воде, он не увеличивает карбонатную жесткость и, следовательно, общую жесткость. Однако существующие тесты KH для аквариумной воды обнаружат его увеличение. Это связано с тем, что они реагируют на все карбонатные и гидрокарбонатные соединения, независимо от того, попадают они в воду вместе со щелочноземельными металлами или нет.
Почему важен показатель KH?
KH тесно связан с другим важным значением pH, которое так же важно для рыб и растений, как и общая жесткость.
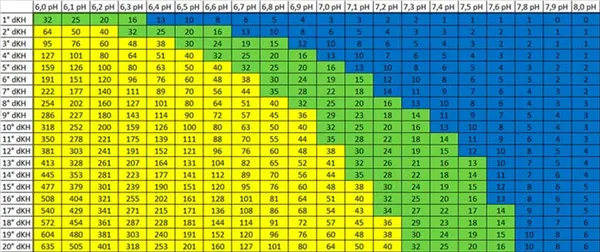
Оба значения напрямую зависят друг от друга. Высокие значения pH означают высокие значения KH. И наоборот, кислые значения pH могут быть достигнуты только при низких значениях карбонатной жесткости (подробнее об этом в таблице ниже).
KH играет особую роль в аквариуме. Карбонатная жесткость не только связана со значением pH, но и служит для поддержания его стабильности. KH служит буфером, который предотвращает быстрые и большие изменения pH.
Жесткая вода
Это вода, в которой присутствует большое количество растворенных щелочноземельных солей. На жесткость воды в основном влияют кальций и магний, соединения которых являются наиболее важными солями жесткости.

Жесткость является решающим фактором не только для питьевой воды, но и для ее использования в быту или в промышленности.
Жесткую воду легко узнать по вкусу — она очень горькая. Иногда горький вкус родниковой воды обусловлен наличием солей жесткости.
Ее можно узнать по внешнему виду после кипячения. В этом случае соли выпадают в осадок, который можно легко увидеть на дне любой емкости.
Классификация воды по жетскости
В России жесткость воды измеряется в градусах жесткости, но также может быть выражена в виде объемной доли или массового числа.
Официальной единицей измерения в СИ (Международной системе единиц) является моль на кубический метр. На практике, однако, эти единицы не используются, вместо них используется эквивалент миллилитра на литр (мг-экв/л).
По уровню жесткости воду делят на четыре типа:
- Мягкая вода (менее 2 миллиэквивалентов на литр);
- Нормальная вода (от 2 до 4 миллиэквивалентов на литр);
- Жесткая вода (от 4 до 6 миллиэквивалентов на литр);
- Очень жесткая вода (6 и более миллиэквивалентов на литр).
Эта классификация называется американской и является наиболее часто используемой классификацией для оценки жесткости воды.
Существует аналогичная классификация жесткости воды, но она охватывает только 3 типа воды:
- Мягкая вода (менее 2 градусов жесткости);
- Вода средней жесткости (от 2 до 10 градусов жесткости);
- Крайне жесткая вода (от 10 градусов жесткости и больше).
Нормы жесткости воды
Стандарты жесткости воды в России и в мире сильно отличаются. В России жесткость воды допускается, если она не превышает 7 миллионных эквивалентов на литр, то есть мы не запрещаем подачу очень жесткой воды.
В Европе жесткость не должна превышать 1,2 миллиона эквивалентов на литр. Это означает, что европейцы пьют мягкую воду, жесткость которой почти в шесть раз ниже, чем в России.
Типы жесткости воды по восприимчивости к термообработке.
Первый тип — временная жесткость, при которой в воде помимо кальция и магния обнаруживаются углеводородные анионы. Ее также называют карбонатной жесткостью. Она легко удаляется кипячением воды и не оказывает влияния на организм человека.
Второй тип — постоянная твердость, также называемая некарбонатной твердостью. Она вызывается соединениями кальция и магния, которые образуются в сочетании с сильными кислотами, такими как серная или азотная. Эта жесткость не устраняется кипячением воды, поскольку данный тип соли не разлагается под воздействием тепла.
Общая жесткость воды рассчитывается путем сложения карбонатной и некарбонатной жесткости.
Самые высокие показатели жесткости наблюдаются в морской и океанической воде, поскольку в ней много растворенных солей. Жесткость поверхностных вод обычно во много раз ниже, чем жесткость подземных вод и грунтовых веществ.
Вред, наносимый жесткой водой
Рассмотрим негативное влияние чрезмерно жесткой воды на здоровье человека, бытовые приборы и коммунальные услуги. Чем выше значение жесткости, тем значительнее вредное воздействие.
Вред для здоровья человека и домашних питомцев
- Высокая жесткость способствует росту мочевых камней и развитию мочекаменной болезни. Это связано с накоплением солей, которые просто не успевают выводиться из организма.
- При умывании жесткая вода сушит кожу. Это происходит из-за появления «мыльных шлаков» образованных из мыла, которое не способно мылиться и растворяться в жесткой воде. Эти мыльные шлаки закупоривают поры, не давая им свободно дышать, вследствие чего могут развиваться кожные воспаления, не давать покоя зуд и жжение кожи.
- Образование тонкой корке на волосах разрушает естественную жировую пленку. Происходит это так же, как и на коже рук – «мыльные шлаки» не вымываются и постепенной накапливаются. Это может вызвать зуд кожи головы, перхоть и даже выпадение волос.
- Влияние сильно жесткой воды на здоровье животных не отличается от воздействия на человеческий организм. Существует высокий риск развития мочекаменной болезни. У питомцев, питающихся сухими кормами, этот риск возрастает в несколько раз. Возможно появление проблем с шерстью и кожей, как у собак, так и у кошек при их регулярном купании.
- Замедляется процесс приготовления пищи, из-за многочисленных солей плохо разваривается мясо. Это приводит к плохому усвоению белка и может вызвать заболевания желудочно-кишечного тракта.
Вред, наносимый жесткой водой технике и предметам быта

- Мыльные средства из-за наличия большого количества солей в воде крайне плохо пенятся и отмывают загрязнения. Поэтому количество порошков, средств, предназначенных для мытья посуды и прочих предметов бытовой химии, придется резко увеличить.
- Кроме плохого вспенивания мыльных средств, из-за контакта жесткой воды с ними образуются разводы и твердый налет на сантехнике и поверхности посуды, так как выпадает солевой осадок. Такой налет тяжело отмывается с посуды, а так же негативно влияет на сантехнику, постепенно разрушая ее поверхности.
- В процессе нагревания воды в электроприборах соли не просто выпадают в осадок, а кристаллизуются и выпадают в виде накипи. Именно накипь является основной причиной быстрой поломки водонагревательных приборов.
- Жесткая вода оставляет пятна, разводы и грязные налеты на свежевыстиранных вещах, цвет тускнеет, принты и рисунки становятся серыми. От них избавиться очень сложно и это, опять же, требует повышенных затрат моющих средств. Ткань, постиранная в жесткой воде, становится грубой и неэластичной, потому что соли забивают в ней все свободное пространство. Уменьшается прочность одежды и белья.
Вредные последствия воды с повышенной жесткостью для коммуникаций

- Соли жесткости так же, как и на бытовых приборах, выпадают в осадок или кристаллизуются, образуя на поверхности коммуникационных путей и крупных приборов и установок накипь. Накипь истончает стенки коммуникаций, впоследствии полностью разрушая их.
- Обилие выпадающих в осадок или накипь солей жесткости, приводит к частым выходом из строя крупных водонагревательных установок, типа бойлеров.
- В системах оборотного водоснабжения, образующиеся накипные отложения, водные камни и шлам из солей уменьшают проходимость труб, при этом падает теплоотдача. Падает напор воды, уменьшается количество воды в радиаторах, закупориваются входы и выходы воды из домов, что может привести к полному закупориванию коммуникационных сетей. Все это увеличивает энергозатраты .
Единицы измерения жесткости воды
Жесткость воды в цифрах — это концентрация ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике используются более удобные единицы.
В России жесткость измеряется в градусах (1°Ж) — миллиграмм-эквивалентах на литр (мг-экв/л или мэкв/л).
- 1°Ж = 1 мг-экв/л. Для сравнения: 1°Ж = 2,8 dH (Германия).
- 1 мг-экв/л = 20,04 мг Ca2+ или 12,16 мг Mg2+ в литре воды.
Таблица жесткости
| Характер воды | Жесткость в мг-экв/л | Степень dH |
|---|---|---|
| Очень мягкая | до 1,5 мг-экв/л | 0–4° |
| Мягкая | 1,5–3 мг-экв/л | 5–8° |
| Средней жесткости | 3–8 мг-экв/л | 9–12° |
| Жесткая | 8–12 мг-экв/л | 13–22° |
| Очень жесткая | выше 12 мг-экв/л | 23–34° |

Норма жесткости
Вода делится на 3 степени жесткости (мы используем «природные» степени жесткости, °H):
- мягкая: до 3°Ж
- средняя по жесткости: 3–6°Ж
- жесткая: >6°Ж
Согласно санитарным нормам, жесткость водопроводной воды не должна превышать 7 мг-экв/л.
На практике даже средняя жесткость вызывает значительный дискомфорт. Уже 4-5 °H становятся заметными: Они оставляют известковый налет на чайнике и пленку на напитках, известковые соли на раковине и белые пятна на посуде, они «забивают» аэратор крана и душевую лейку.
Нормы жесткости для воды
Стандартизация определяется документами по стандартизации. Точные данные получают путем испытания образцов в аккредитованных лабораториях, санитарно-эпидемиологических станциях. Для регистрации лабораторных измерений приняты международные единицы измерения жесткости воды:
- моль/м 3 — количество молей на кубический метр жидкости;
- мг-экв/л — миллиграмм-эквиваленты на кубический дециметр (на 1 литр);
- °Ж — градус жесткости.
Единицей измерения жесткости воды является 1 мг-экв/л, что эквивалентно 1/2 миллилитра на литр. Допустимые значения для ионов кальция и магния различны: для Са2+1°Ж=20,04, для Mg2+1°Ж=12,16 мг/л (примечание: эти значения используются в формуле расчета, см. ниже в тексте*).
Вода может быть мягкой, средней или жесткой. Мягкая вода — это дистиллированная вода, кипяченая вода, дождевая и талая вода. Вода средней жесткости поступает из магистральных водопроводов. Артезианская вода и родниковая вода также имеют среднюю степень жесткости. Вода из водоносных горизонтов с соленой водой, которую приходится опреснять, считается водой с высокой степенью жесткости. В таблице приведены концентрации солей в различных единицах измерения.
Предельно допустимое содержание солей жесткости в воде
| Степень жесткости воды | Показатель в мг-экв/л | Показатель в °Ж | Показатель в ppm |
| Слишком мягкая | до 1,5 | до 1-1,5 | 0-70 |
| Мягкая | 1,5-4 | 1,6-4 | 71-140 |
| Среднежёсткая | 5-8 | 5-12 | 141-210 |
| Сильножёсткая | 9-12 | 13-22 | 211-320 |
| Сверхжёсткая | свыше 12 | 23-34 | 321-530 |
Нормы жесткости для питьевой воды
СанПиН дает переменные значения, в зависимости от применения водных растворов. Жесткость воды по ГОСТУ также корректируется в зависимости от типа и назначения жидкостей:
- Для обычной сетевой водицы определяется концентрация магния (до 50 мг/л).
- В бутилированной учитываются показатели Ca = 25-130 и Mg = 5-65 мг/л.
- Для воды, использующейся в хозяйственно-питьевых целях ПДК питьевой воды по жесткости не должно превышать 350 мг/л (7-10 мг-экв/л или 1-1,5 грамма на литр).
- Для напитков высшей категории нормой является Жо=1,5-7, для первой не более 7 мг-экв/л.
- По ВОЗ-нормативам в питьевой водице допустимо 10-30 мг магния и 20-80 мг кальция на 1 литр.
- Общая жесткость для питьевой воды по EC не выше 1,2 мг-экв/л.
Нижние пределы значений жесткости для питьевой воды указаны в нормативах. В обычной воде должно присутствовать небольшое количество солей. Кальций полезен для организма, а его микроэлементы лучше усваиваются из напитков, чем из пищи. Массовая концентрация кальция в питьевой воде должна быть не менее 0,12, магния — не менее 0,04, а сульфата и хлорида — не менее 2 мг/дм3. Мягкая вода вымывает кальций из организма, что приводит к неприятным последствиям — повреждаются кости и зубы. Очень жесткая вода вызывает образование камней в организме и нарушает работу выделительной системы. Соленая вода разрушительно действует на водопроводные системы, забивает стенки труб отложениями и увеличивает расходы на отопление.
Если вода содержит больше солей жесткости, чем предписано стандартами, ее необходимо очистить до приемлемого уровня. В таблице указана концентрация солей по шкале жесткости в промилле.
Шкала жесткости
| Концентрация солей | Величина в ppm (в промилле или мг/л) |
| Представляющая опасность для жизни | свыше 500 |
| Предельно допустимая | 500 |
| Средний показатель вод, добываемых из природныхводоемов | 400 |
| Допустимое значение воды, подающейся из водопровода | 300 |
| После прохождения угольных фильтров | 170 |
| После очистки системой обратного осмоса | 0-50 |
Нормы жесткости для технической воды
Какой жесткости должна быть вода в котле — стандарт устанавливается отдельно для котлов с разным давлением:
- до 1,4 МПа (14 кгс/см 2 ) = 15-20;
- 2,4 МПа (24 кгс/см 2 ) = 10-15;
- 3,9 Мпа (40 кгс/см 2 )= 4-10 мкмоль/дм 3 (мкг-экв/дм 3 ).
Первый (самый низкий) показатель применяется к жидкотопливным котлам с тепловым потоком более 350 кВт на квадратный метр. Второй (более высокий) показатель применяется к котлам, работающим на других видах топлива, с тепловым потоком до 350 кВт/м2.
ГОСТ по определению жесткости воды указывает, какие параметры являются допустимыми:
- для электронного производства,
- для гальваники,
- для энергетики,
- для медицинских процессов,
- для подпиточной и добавочной воды для котлов.
Питьевая вода разной степени жесткости распределяется отдельно: дистиллированная вода, сетевая вода, бутилированная вода. Показатели для солей железа рассчитываются отдельно.
Как вычислить жесткость в домашних условиях
На повышенную жесткость не указывают внешние признаки — запах, цвет, консистенция. На это указывает :

- образующаяся накипь на дне чайника;
- плохое вспенивание моющих средств;
- белые разводы на душевой лейке в ванной.
Точный состав воды можно определить только с помощью анализа. Но есть и простой способ определить жесткость водопроводной воды в домашних условиях с погрешностью в 1-2 градуса.
Для эксперимента вам понадобятся: брусок хозяйственного мыла, небольшое количество дистиллированной воды, электронные весы, контейнер, цилиндрический стакан и линейка.
- Мелко натереть 1 г хозяйственного мыла и растворить его в 3–4 столовых ложках слегка подогретой дистиллированной воды. Если под рукой нет кухонных весов, можно ориентироваться на глаз – пол чайной ложки без верха.
- В стакан с мыльным раствором долить дистиллированной воды так, чтобы высота столба жидкости соответствовала процентному содержанию жирных кислот, указанному на бруске мыла. Если 72%, то высота водяного столба должна составлять 72 мм от дна стакана, но не от поверхности стола.
- Набрать в ёмкость 0,5 л водопроводной воды и, плавно помешивая, вливать в неё тонкой струей мыльный раствор. Сначала в воде появятся хлопья, пузыри, затем – стойкая белая пена. Она свидетельствует о том, что уже связаны все соли.
Вычислите количество сантиметров водяного столба, перенесенного в контейнер, вычитая высоту оставшегося мыльного раствора из первоначального:
- hп— высота столба перелитого раствора;
- hи– высота водного столба исходного мыльного раствора;
- hо– высота столба остатка мыльного раствора.
Каждый сантиметр раствора, перешедший в емкость, соответствует 2ºdH. Эта величина идентична немецкой единице жесткости. Например, 4,6 см3, слитые из банки, равны 9,2 dH .
Вы можете использовать таблицу для перевода результатов в мг-экв/л и калькулятор для получения точных показаний.
| № | Степень dH | Степень твердости | Значение в мг-экв/л |
|---|---|---|---|
| 1 | 0 — 4 | Очень мягкая | До 1,4 |
| 2 | 5 — 11 | Мягкая | 1,8 – 4,0 |
| 3 | 12 — 22 | Средняя | 4,3-8,0 |
| 4 | 22 — 34 | Жесткая | 8,0-12 |
| 5 | Более 34 | Очень жесткая | Выше 12 |
Более точные результаты можно получить с помощью электронных измерителей TDS-3. Они анализируют жесткость и кислотность воды и отображают результаты в виде RPM или pH. С помощью калькулятора вы можете перевести единицы измерения из оборотов в ºJ. Если вы хотите получить подробный анализ воды в скважине или колодце, то это можно сделать набором «Скважина-1».
Если вы хотите получить подробный анализ воды в скважине или колодце, то это можно сделать набором «Скважина-1». Если вы хотите получить подробный анализ воды в скважине или колодце, то это можно сделать набором «Скважина-1».
Если вы хотите получить подробный анализ воды в скважине или колодце, то это можно сделать набором «Скважина-1».Еще один простой и недорогой способ определить качество воды — тест-полоски.

Влияние воды
На организм человека

До сих пор нет серьезных исследований, доказывающих вредное воздействие жесткой воды на живые организмы. Известно, что длительное употребление воды с повышенной жесткостью способствует развитию мочекаменной болезни. Организм не успевает вывести избыток минералов, что приводит к образованию мочевых камней, камней в почках и отложений в суставах.Качество воды также важно для гигиены. Мыло вступает в реакцию с солями кальция и магния и ослабляет защитный барьер кожи, вызывая раздражение или аллергию. Волосы становятся сухими и ломкими. В то же время кальций и магний жизненно важны для человека:
- дневная норма кальция составляет 1000 мг ;
- магния – 400 мг .
Дефицит этих элементов может нанести серьезный ущерб организму. ВОЗ утверждает, что употребление слишком мягкой воды приводит к потере солей и изменению водно-солевого баланса. Это наблюдалось в районах, где используется мягкая вода:
- рост сердечно-сосудистых заболеваний;
- возрастание количества переломов у детей и снижению веса новорожденных.
ВОЗ утверждает, что наличие солей в воде следует считать необходимым для нормального функционирования организма.
На технику
Соли жесткости вызывают множество проблем в бытовых приборах и на промышленных предприятиях:

- слой накипи, образующийся на стенках стиральных и посудомоечных машин, приводит к преждевременной поломке;
- краны и душевые лейки забиваются известковым налетом;
- недостаточное вспенивание стирального порошка ведет к его перерасходу;
- покрытые накипью трубы и ТЭНы увеличивают расход электроэнергии и выходят из строя;
- выпадающие в осадок соли уменьшают проходимость труб в системах водоснабжения, снижая напор воды;
- нерастворимые соединения на стенках радиаторов становятся мощным теплоизолятором, снижая их теплоотдачу.
Слишком мягкая вода оказывает негативное воздействие на бытовые приборы и повышает риск коррозии труб из-за низкого содержания щелочи. Поэтому важно поддерживать правильный баланс между водой и солями.
Способы умягчения воды
Существует несколько способов снижения жесткости. Выбор зависит от исходного качества воды, предназначения и условий эксплуатации.
Термический метод
Кипячение — самый простой и дешевый метод удаления карбонатной жесткости. Он подходит для небольших объемов воды для бытового использования. Однако этот метод не удаляет все соли жесткости, и емкости необходимо опреснять.
Фильтрация
Не так давно фильтр для умягчения воды представлял собой внушительное оборудование. Современные технологии и материалы позволили создать компактные фильтры для умягчения воды, которые легко помещаются под кухонной мойкой. Помимо умягчения воды, сменные картриджи фильтров удаляют запахи и примеси. Правильный выбор фильтров и своевременная замена гарантируют качественную очистку воды из водопровода, колодца или скважины. Одной из современных комплексных систем является барьерный фильтр.

Химические способы
Для осаждения солей жесткости в воду добавляют специальные реагенты, например, гашеную известь, соду, полифосфаты. Этот метод подходит для промышленного применения. Его основным недостатком является необходимость дальнейшей утилизации отходов. Вода не пригодна для употребления в пищу.
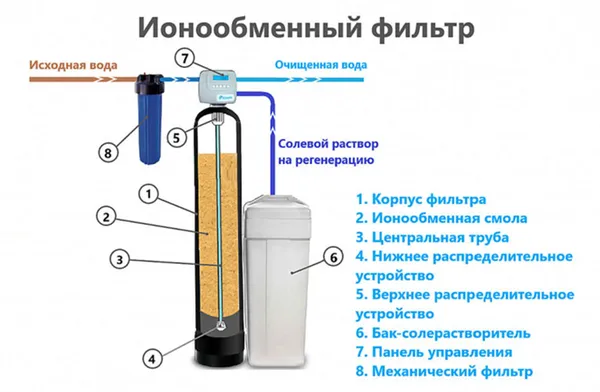
Ионный обмен
Фильтрация с помощью ионообменных смол успешно используется в промышленности. Принцип основан на замене катионов щелочноземельных металлов на ионы натрия и водорода в тонко заполненной колонке. Для регенерации отработанной смолы используется солевой раствор. При изменении жесткости воды необходима ручная регулировка.
Физические методы
Эти процедуры основаны на электродиализе, ультразвуке и электромагнитных импульсах. Соли жесткости переходят в измененное состояние, в котором они не кристаллизуются в твердый осадок, а образуют нестабильные соединения. Применение ультразвука и электромагнитных волн дополнительно способствует удалению имеющихся солей.
Мембранный метод
Этот метод очистки также называется обратным осмосом. Вода пропускается под высоким давлением через фильтр с мельчайшими ячейками и полностью освобождается от химических примесей, взвешенных веществ и бактерий. Качество воды приближается к качеству дистиллированной воды. Прежде чем воду можно будет пить, ее необходимо дополнительно минерализовать. Недостатком этого метода является его высокая стоимость.

Как измерить и понять, допустимая или повышенная жесткость – способы

Мы представляем три варианта:
- Наиболее точный – заказать лабораторный анализ. Во время пристального изучения будет произведен разбор на химические вещества, поэтому справка не только покажет общий показатель, но и конкретное содержание микроэлементов – какие и в каком объеме присутствуют в образце. Необходимо делать такую экспертизу владельцам частных домов при оборудовании скважины или колодца и заказе фильтрационной системы.
- Быстрый и доступный каждому. Для этого стоит приобрести тестер в виде бумажной полоски. Его нужно опустить в жидкость, подождать указанный период, а затем определить цвет индикатора. Дело в том, что на активную части нанесен реагент, который вступает в реакцию и показывает количество примесей. Минус в сложности интерпретации и достаточно неточных результатах.

- Домашний химический опыт. В два одинаковых мерных стакана следует нарезать по одному грамму хозяйственного мыла 72%. Затем залейте их подогретой водой – в одну емкость дистиллированной, во вторую водопроводной. В первом бокале будет уровень 7 см. А во втором – остановитесь вливать жидкость в тот момент, когда появится мыльная пена. Затем измерьте разницу влитой влаги. Каждый 1 см раствора соответствует двум °dH.
Какая должна быть оптимальная жесткость воды – норма
Не существует единых единиц измерения или стандартов для всего мира. Однако в России в 2014 году были введены строгие стандарты, определенные ГОСТ 31865-2012. В нормативном документе показатель выражается в градусах и обозначается как °Дж. Он соответствует одному мг-экв/л. Рассмотрим таблицу норм, принятых в нашей стране и в Америке:
Предельные нормы в России, в мг-экв/л
Как видите, российские требования гораздо мягче. По этой причине оборудование, произведенное в Америке, выдерживает контакт с нашим трубопроводом гораздо хуже, чем в их собственной стране.
Если сравнивать европейские показатели на примере Германии, то мы сталкиваемся с той же проблемой — у нас слишком эластичные рамки для среднего качества. Поэтому почти любая водопроводная вода подходит под стандарт.

Но пить такую жидкость просто небезопасно. Поэтому не стоит полагаться на государственные стандарты, позаботьтесь о здоровье своих домочадцев сами. Обратитесь в компанию «Домашняя вода» за комплексной услугой по установке системы фильтрации в вашем доме.
Нормы для питьевой воды
Этот показатель регламентируется не столько ГОСТом, сколько Всемирной организацией здравоохранения и СанПиНом. Согласно рекомендациям ВОЗ, в одном литре питьевой воды не должно содержаться более 30 мг магния и 80 мг кальция. Однако СанПиН 2.1.4.1074-01 предписывает запасы магния до 50 мг; содержание солей кальция не регламентируется. Зато указана общая жесткость — до 7 градусов.

SF-mix Clack до 0,8 м3/ч

SF-mix Runxin до 0,8 м3/ч

SF-mix manual до 0,8 м3/ч
Последствия чрезмерно жёсткой воды
Умягчение при высокой временной карбонатной, постоянной некарбонатной или общей жесткости является обязательным, так как повышенная концентрация солей магния и кальция вызывает проблемы:
- Поломки, преждевременный выход из строя бытовой техники. Накипь, которую образуют соли жёсткости при нагревании, откладывается на контактирующих с водой внутренних стенках корпуса и нагревательных элементах приборов – посудомоечных и стиральных машин, парогенераторов, а также отопительного и водонагревательного оборудования (бойлеров, котлов). В результате уменьшается их производительность, повышается потребление электроэнергии, ускоряется процесс износа ТЭНов и прочих главных узлов. Технические характеристики устройств ухудшаются, риски неисправностей увеличиваются.
- Сухость волос, кожных покровов тела. При частом умывании, мытье головы или купания в чрезмерно жёсткой воде состояние кожи ухудшается, возникает шелушение. Волосы становятся сухими и ломкими.
- Снижение напора воды. Так как налёт накипи может забивать трубы системы горячего водоснабжения, струя становится меньше.
- Увеличение расхода моющих средств. Мыло и иные моющие и гигиенические средства в чрезмерно жёсткой воде демонстрируют небольшое пенообразование, поэтому приходится увеличивать объёмы.
- Негативное влияние на организм человека. Соли магния и кальция, как и иных химических элементов, могут откладываться в почках, провоцируя развитие мочекаменной болезни. Есть данные о высоких рисках появления сердечно-сосудистых заболеваний при постоянном употреблении жёсткой воды, но научных подтверждений такая информация не имеет.
Методы устранения жёсткости водопроводной или скважинной воды
Каковы основные методы устранения жесткости воды? Концентрацию солей магния и кальция можно уменьшить различными методами. Выбор зависит от типа жесткости, количества соединений Mg и Ca в воде и наличия других химических элементов.
В приведенной ниже таблице кратко описаны варианты снижения жесткости воды для различных типов воды:
| Вид жёсткости | Методы снижения концентрация солей магния и кальция |
| Временная, она же карбонатная | Термические (физические) способы – кипячение |
| Постоянная, она же некарбонатная | Химические методы, например, добавление кальцинированной соды |
| Общая | И термические, и химические способы: нагревание и кипячение, замораживание и последующее оттаивание, введение в состав гашёной извести или кальцинированной соды, ионообменные и обратноосмотические системы, фильтры-умягчители |
Далее подробно описаны все методы устранения повышенной жесткости воды.
Кипячение

Если рассматривать жесткость воды и способы ее устранения, то одним из простых бытовых методов является обычное кипячение. Этот способ известен как термическое умягчение, при котором воду либо кипятят, либо нагревают до высокой температуры — не менее 70 градусов.
Кипячение обеспечивает удаление временной жесткости. Нагревание запускает реакцию, в ходе которой гидрокарбонаты просто расщепляются. При этом образуется побочный продукт — угольная кислота. Основные карбонаты и карбонат кальция выпадают в виде твердого осадка, который образует накипь и взвешенные частицы в виде хлопьев и примесей на поверхности.
Главное преимущество этого метода — его простота. Метод эффективен и подходит для использования в домашних условиях, в повседневной жизни. Однако термические методы удаления временной жесткости воды не подходят для постоянной, некарбонатной жесткости. Они не удаляют оставшиеся щелочноземельные соли. Кроме того, эффективность и энергозатраты низки, если рассматривать жесткость воды и ее удаление путем нагрева. Трудно умягчить большое количество жидкости за короткое время. Кроме того, для термической обработки требуется источник нагрева
Реагентное, химическое умягчение
Реагентное, т.е. химическое умягчение, подразумевает использование соединений и веществ, запускающих химические процессы. Соли жесткости удаляются путем перевода их из растворимой формы в нерастворимую, а затем жидкость очищается от образовавшегося осадка.
Вода используется для химического снижения жесткости:
- Полифосфаты натрия, например, ортофосфат, который входит во многие средства умягчения для бытового и промышленного использования.
- Кальцинированную соду. Она превращает соли кальция в карбонаты нерастворимого вида. Образовавшийся осадок убирается фильтрацией на следующем этапе очистки.
- Гашёную известь. Карбонатную, временную жёсткость воды можно устранить с помощью гидроксида кальция.
- Одновременно гашёную известь и кальцинированную соду. Если нужно понизить общую либо постоянную жёсткость воды, то следует использовать данную комбинацию. В процессе такого умягчения известь будет воздействовать на гидрокарбонаты и карбонаты, а сода – на другие соли.
Что выбрать
Если вам необходимо качественное и эффективное умягчение жесткой воды, система очистки должна быть правильно спроектирована для выполнения этой важной задачи. При выборе системы очистки учитывайте следующие факторы:
Для того чтобы жесткая вода была умеренно мягкой и качественной, ее необходимо эффективно умягчить. Существует несколько способов сделать это, и при выборе подходящей системы следует учитывать основные факторы, перечисленные выше. Рекомендации, приведенные в данной статье на этом сайте, помогут вам подобрать оптимальный вариант и добиться эффективного умягчения для максимально возможного качества воды.








